El
nitrógeno es el gas más abundante de la atmósfera (Supone el 78%). A pesar de
ello, casi nunca se habla de él. No nos cabe ninguna duda de la importancia del
oxígeno, pues lo respiramos. Tampoco tenemos ninguna duda de la importancia del
hidrógeno, porque supone el 99% de toda la materia que conocemos. Pero… ¿Y el
nitrógeno? Vamos a ver si aprendemos algo sobre este misterioso gas.
El
nitrógeno, descubierto formalmente en 1772 por Daniel Rutherford (No confundirlo
con Ernest, el del modelo atómico de un siglo después), consta de 7 protones y, por lo tanto, 7 electrones. Como sabes,
los dos primeros electrones completan la primera capa así que nos quedarán 5
para la segunda, que no estará completa si no encontramos 3 electrones más. Eso
es lo que va a ansiar todo átomo de nitrógeno que se precie.
Hay
dos maneras muy comunes de conseguir esos 3 electrones extra: Juntarse con 3
átomos de hidrógeno y formar amoniaco (NH3), un gas que huele fatal y que se
utiliza, principalmente, como abono para las plantas, o, la más común de las
dos: Compartiéndolos con otro átomo de nitrógeno: Tú me dejas 3 electrones y yo
te dejo otros 3 y así, los dos, unidos, formamos una molécula con 8 electrones
en su capa más externa: N2. (Esto también lo hacen el hidrógeno y el oxígeno,
por ejemplo, H2 y O2. Enlaces diatómicos, los llaman).
Es
la molécula de N2 la que abunda tanto en la atmósfera. Nosotros la inspiramos y
la expiramos como si nada. En ese estado, el N2 es como un gas noble: No
reacciona con nada. Y esa es una característica que marcará muchos de sus
posibles usos.
Por
supuesto, el nitrógeno se junta con otros elementos y forma muchos otros
compuestos. Se encuentra dentro de nosotros formando algunas moléculas importantísimas
para la vida: Los aminoácidos, que forman las proteínas (Los aminos (NH2),
que suelen unirse a cadenas con carbono), los ácidos nucleicos (ADN o ARN, que
están formados por bases nitrogenadas), las hormonas o las vitaminas son claros
ejemplos de ello. Lo obtenemos de las plantas, que lo obtienen gracias a unas
bacterias del suelo que lo convierten en nitratos. (Las plantas carnívoras, por ejemplo, cuando cazan una mosca lo que buscan es el nitrógeno de la misma).
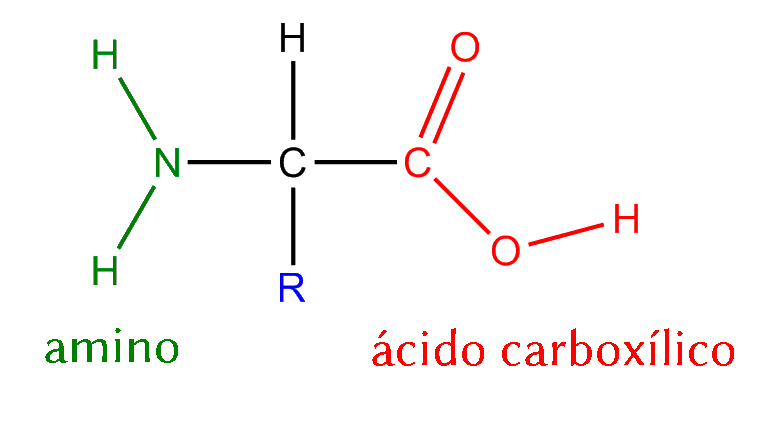 |
| Ejemplo de aminoácido, con su típico amino. Crédito: Wikipedia. |
Actualmente,
como digo, el nitrógeno es utilizado sobretodo como amoniaco para fertilizante. Gracias en gran parte a un químico, Fritz Haber, que logró la primera patente del proceso llamado "Haber-Bosch", que utiliza el nitrógeno de la atmósfera para fabricar amoniaco. Lamentablemente Haber utilizó sus conocimientos para producir gases para la guerra, como por ejemplo el Gas Mostaza.
Pero el nitrógeno tiene muchos otros usos: Se utiliza como nitrato de
potasio, o nitro, para fabricar pólvora. Estos compuestos se fabrican a partir
de ácido nítrico (aqua fortis, como lo conocían en la época medieval) (HNO3), que se obtiene del salitre (Salitre en griego es
nitron, y de ahí su nombre). Algo casi tan explosivo como la pólvora, la
hidracina (N2H2), es utilizada como combustible en los cohetes espaciales. Por
otra parte, seguro que el óxido nitroso (N2O) no te dice nada pero si te digo “gas
de la risa”, la cosa cambia, ¿no?. Igualmente, imagino que no te suena el óxido
nítrico (NO) pero si te hablo de que lo que hace el viagra es liberarlo… quizás
te de la risa. Poca risa si en lugar de eso tenemos NO2, que es un gas tóxico
que se encuentra entre los gases que expulsan los coches.
Como
ya he dicho, el N2 es muy poco reactivo, así que se puede utilizar para crear
atmósferas protectoras para, por ejemplo, envasar alimentos. Al no contener
oxígeno, las bacterias que harían que la comida se pusiese mala no pueden
vivir, con lo que el alimento se mantiene en perfecto estado. Lo de que no
tenga oxígeno también es bueno para las bombillas. Las bombillas constan de un
cable por el que pasa una corriente eléctrica. El cable es muy fino y en
condiciones normales ardería y se fundiría pero, si no hay oxígeno no puede arder,
con lo cual, nos ilumina. Lo de que no tenga oxígeno funciona con las
bombillas pero no con los seres humanos… en 1981 tres técnicos de la NASA
murieron por culpa del nitrógeno que se utilizaba para barrer el oxígeno de la zona
de los motores del Columbia, para así reducir el riesgo de incendio (como en
las bombillas). Debían entrar en un pequeño cubículo lleno de aire normal pero ese
día no se retiró el nitrógeno por un cambio a última hora. El problema es que
el nitrógeno no podemos detectarlo porque no huele y nuestro cuerpo no detecta
la falta de oxígeno con lo que, simplemente, te desmayas y en poco tiempo
mueres. (Cuando te metes debajo del agua más tiempo del aceptable, lo que
detecta tu cuerpo es la falta de gas, sea cual sea, y no la ausencia de
oxígeno, que es lo que te va a perjudicar realmente).
 |
| El Columbia siendo lanzado en 1981. No usaba hidracina sino combustible sólido, que por cierto también tiene nitrógeno. |
Otra
situación en la que el nitrógeno puede ser peligroso la conocen todos los
buceadores. No se debe a la falta de oxígeno o de aire, sino al efecto de la
presión en nuestro organismo. Cuando te sumerges a unos cuantos metros de
profundidad, la presión hace que los gases en tu interior se compriman. El
nitrógeno lo hace de tal manera que pequeñas burbujitas del mismo pueden
introducirse en tu torrente sanguíneo. Dichas burbujas reducidas al mínimo por
el efecto de la presión crecerán cuando salgas del agua y, si sales muy rápido
podrían crecer dentro de tus venas y causarte problemas. Es por ello por lo que
los buceadores realizan unas pausas a diferentes alturas antes de salir a la
superficie, para que esas gotitas salgan del torrente sanguíneo poco a poco.
Por si no había pocos peligros con el amoniaco, recientemente, supongo que recordarás, hubo una tremenda explosión en Beirut, El Líbano. Lo que explotó fue nitrato de amonio (NH4NO3), un componente bastante inestable (como quedó patente el 4 de agosto del 2020) que se usa como fertilizante o como explosivo. No explota si no se calienta mucho, pero en el almacén donde tenían una enorme cantidad de nitrato desde hace años, lamentablemente, hubo un incendio. El N2 gas es muy estable pero cuando está en otros sitios, el nitrógeno, puede ser peligroso: Busca unirse con otro átomo de hidrógeno y al hacerlo libera mucha energía. Además, pasar de sólido a gas, si la cantidad es muy grande y se hace en poco tiempo, genera una gran onda expansiva, que es lo que se vio en la explosión. Porque es que si encima tienes mucho oxígeno y mucho hidrógeno, que son dos gases explosivos, pues ya tienes el lío. (El oxígeno por un lado se quema, acelerando la reacción y por otro, crea vapor de agua, que es un gas: De nuevo, de líquido a gas). Además, en una explosión de nitrato de amonio también se forma NO2 (Que es el gas rojo que se vio tras la explosión) éste es tóxico, como ya he dicho.
Si
el nitrógeno no se usa en grandes cantidades y espacios pequeños, como el
compartimento donde se introdujeron los técnicos americanos, no tiene ningún
peligro. Y, debido precisamente a eso es muy común utilizarlo como refrigerante
(El hidrógeno y el helio son mejores refrigerantes pero el primero es peligroso
y el segundo escaso y, por lo tanto, caro). Existe en muchos laboratorios del
mundo en su estado líquido, es decir, a 195ºC ¡bajo cero! (yo mismo trabajé con
él en mi proyecto final de carrera para enfriar unos pequeños circuitos
electrónicos).
Siguiente elemento: El oxígeno.

No hay comentarios:
Publicar un comentario