Tenemos que avanzar un poco más en el conocimiento del átomo para entender cómo funciona la Tabla Periódica, es decir, cómo están ordenados los átomos en la misma y qué diferencias existen entre unos y otros.
Bien, ya sabes que lo que define a un átomo es su número de protones, esto es: El número atómico. Dentro de un elemento, además, sabemos que puede haber diferentes isótopos. Por ejemplo, existen el Carbono 12 y el Carbono 13. El 12 y el 13 es el número másico, que es la suma entre neutrones y protones. Así, si sabemos que el Carbono tiene 6 protones (el número atómico es siempre fijo), los isótopos C12 y C13 tendrán 6 y 7 neutrones respectivamente. El Carbono, por cierto, normalmente se encuentra con 6 neutrones (solo un 1% de los átomos de carbono tienen 7 neutrones).
Por otro lado, normalmente el número de electrones coincide con el número de protones.
Los electrones, como sabes, se encuentran alrededor del núcleo atómico. Se encuentran en lo que se denominan orbitales. Los electrones se encuentran "orbitando" al núcleo en unas capas con una energía determinada. Para pasar de una capa a otra, tendrán que liberar o ganar cierta energía.
Por lo general, la distribución de los electrones en el átomo es constante y conocida. Para saber cómo están los electrones distribuidos hay que conocer un poco los 4 números cuánticos: n, l, m y s.
- n es la capa. Define el tamaño del orbital. (K,L,M...).
- l es la subcapa. Define la forma del orbital. ("l" tiene un valor de n-1) (s,p,d,f,g,h).
- m determina la orientación del orbital. (m tiene valores desde -"l" hasta +"l").
- s es el spin, y solo puede tomar dos valores. +1/2 y - 1/2.
La distribución de los electrones en el átomo se realiza según estos 4 números y unas reglas sencillas. Al final, lo que más nos interesa es el número de capas y los electrones que quedan en la última capa o capa de Valencia.
En cada capa, por cierto, hay 2n^2 electrones. (Dos por n al cuadrado).
En cada capa, por cierto, hay 2n^2 electrones. (Dos por n al cuadrado).
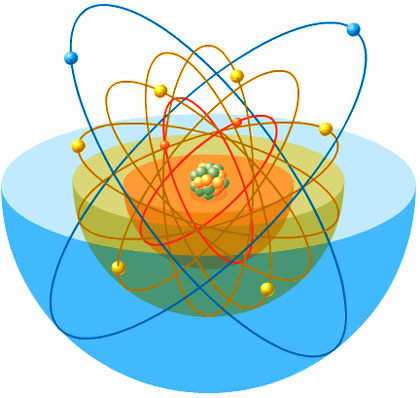 |
| Imagen intuitiva de lo que sería un átomo con sus capas y subcapas... |
Cuantos más electrones tenga un átomo, más capas. Cuantas más capas, más alejados están los electrones del núcleo, con lo cual, menos atracción les proporciona éste. Esto se compensa porque cuantos más electrones, más grande es el núcleo, con lo cual atrae más.
Si la última capa no está completa (no está completa si el número de electrones es menor que 2n^2), el átomo podrá desprenderse de los electrones que le sobran o atraer otros y, de esa manera, formar compuestos con otros elementos. (Del mismo modo que si la capa de Valencia está llena, el átomo no reaccionará fácilmente).
De momento, espero no haberla liado mucho. Para aprender más, puedes buscar los modelos atómicos de Dalton, Rutherford, Bohr y Somerfield, las teorías de Planck (los cuantos), la dualidad onda-partícula de De Broglie, el principio de incertidumbre de Heisemberg, el principio de exclusión de Pauli (electrones apareados) o la regla de Hund (forma de organizar orbitales).
Si quieres saber cómo se organizan los electrones, basta saber cuáles son los valores de los 4 números cuánticos y regirse por una tabla que tiene la siguiente pinta:

Nota: las letras son el valor de l.
Si n=1 (Es decir, en la primera capa). l=0. m=0. Y hay dos electrones, con spins: +1/2 y -1/2.
Si n=3. l=2 (d). m=(-2, -1, 0, +1, +2). Y para cada m, hay dos spins: +1/2 y -1/2.
Ver siguiente entrada: La Tabla Periódica.
Volver al índice del blog.
Este comentario ha sido eliminado por el autor.
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminar